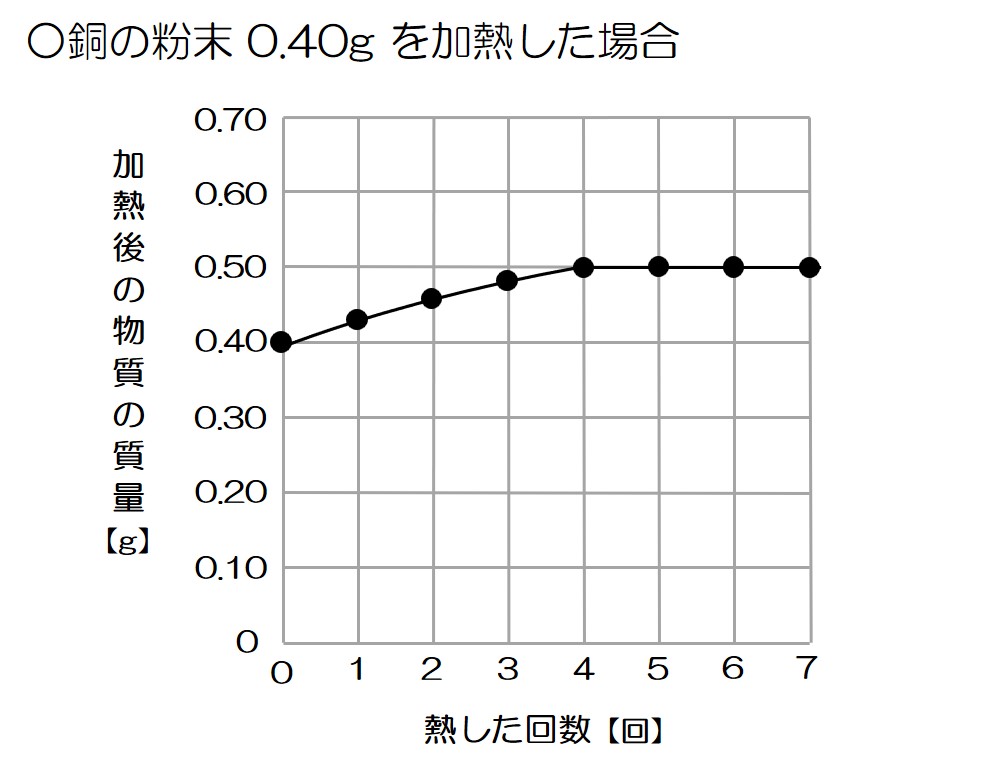
Q.銅の粉末0.40gをステンレス皿にとり、加熱し、冷えてからかき混ぜて質量をはかった。この操作を7回くり返し、結果をグラフに示した。以下の問いに答えなさい。
(1)銅が酸素と結びつくと、何ができるか。物質名を答えなさい。
(2)このときの化学変化を化学反応式で表しなさい。
(3)4回目以降、物質の質量が増えないのはなぜか。
(4)銅と酸素が完全に結びつくときの質量の割合を、最も簡単な整数比で表しなさい。
A.
(1)銅が酸素と結びつくと、何ができるか。物質名を答えなさい。
酸化銅
(2)このときの化学変化を化学反応式で表しなさい。
2Cu + O2 → 2CuO
(3)4回目以降、物質の質量が増えないのはなぜか。
例:銅が酸素と完全に結びついたから。
(4)銅と酸素が完全に結びつくときの質量の割合を、最も簡単な整数比で表しなさい。
4:1

今回は基礎問題!銅の酸化をきっちりおさえるんや~!
解説
↑ の記事はもう読んでくれたかな?
「銅と酸素が結びつくときの割合」で銅の酸化と質量の変化について説明してるよ!
それじゃあ、下の4ステップで考えていこう!
銅の酸化
まずは、(1)の問題から!
銅と酸素が結びつくと何ができるのか?まずはそこからだ!
そもそも、物質が酸素と結びつくことを「酸化」という!
「酸化」してできる物質の名前は、いたってシンプル!
「酸化○○」
という風に、名前の最初に「酸化」をつけるだけでよい!(中学校ではほとんどこれ)
「酸化鉄」とか「酸化マグネシウム」とか!
『酸化マグネシウムごっこするもの
このゆびとーまれ!』
はい、すみません。これ好きなんです笑
話をもとに戻そう!
今回は「銅」が「酸化」するので、
「酸化銅」
でオッケーだ♪
化学反応式
次は、(2)の問題!
銅と酸素が結びつくときの化学反応式は1つだけ注意が必要だ!
↓よくあるまちがった化学反応式がこれ
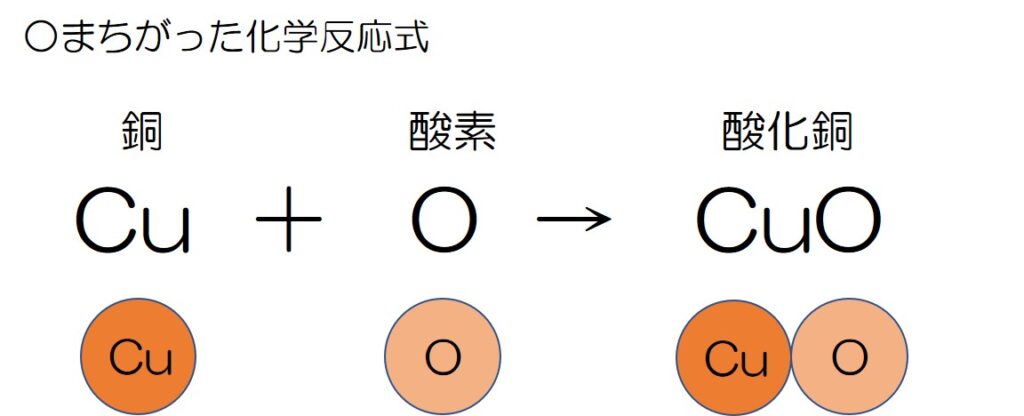
何がまちがっているか分かったかな~?
一見すると、「銅」と「酸素」が結びついて「酸化銅」ができているから何の問題もなさそうだよね?
ところが!
そこには思わぬ落とし穴が…!!
自然界では、酸素は「O」という原子で存在してるわけではなく「O2」という分子で存在している!
というわけで、化学反応式を書くときもそのことを反映して書く必要があるのだ!
↓つまり、正しい化学反応式はこれ♪
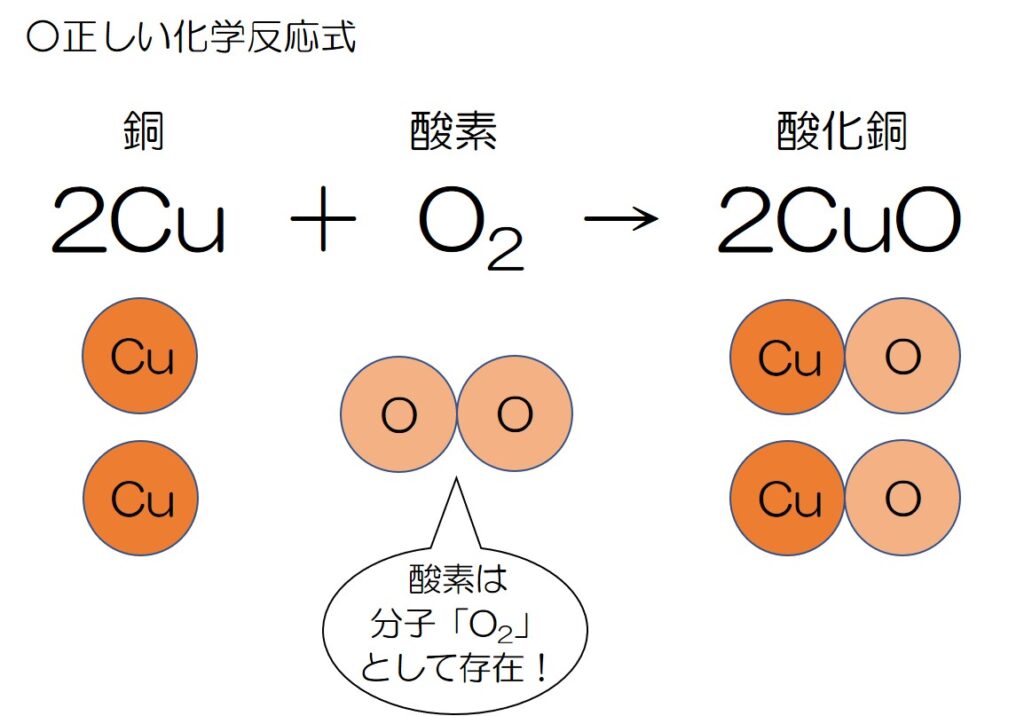
そのため、「銅 Cu」と「酸化銅 CuO」の数は、
酸素の数に合わせてそれぞれの先頭に「2」とつけることがポイントだよ♪
酸素が結びつくことのできる限界
つづいて(3)の問題!
↓のグラフで確認すると、熱した回数が1~3回では加熱するほど質量が大きくなっていることから、反応がまだ完全には終わっていないことが分かるね!
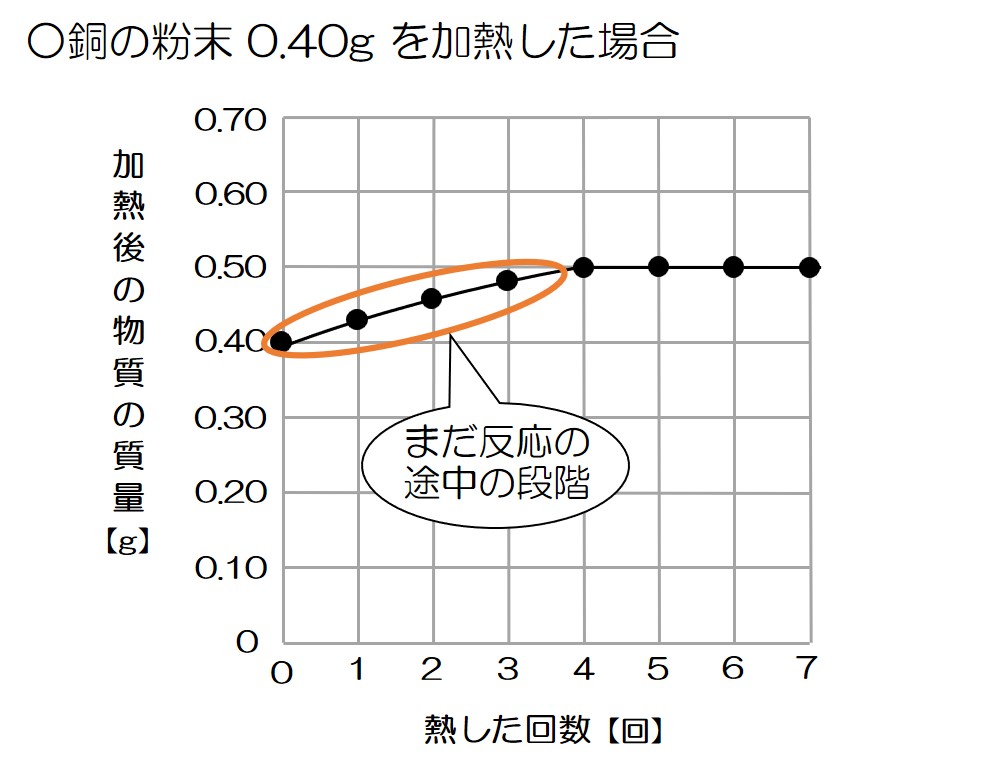
↓反応が途中のイメージってこんな感じ
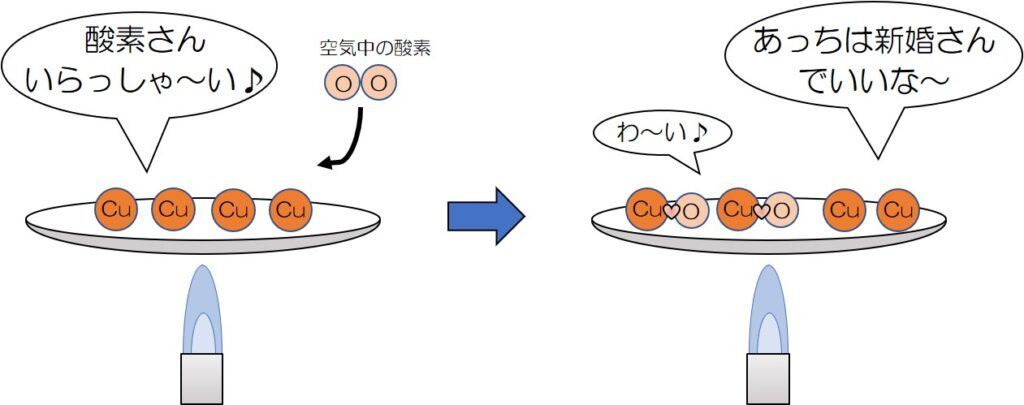
このように、加熱が不十分だと、
酸素と結びついて新婚ホヤホヤになっている銅原子(つまり酸化銅の分子)もいれば、
まだ酸素と結びついていない銅原子も残っている!
そのため、何回も加熱してすべての銅原子を完全に反応させる必要があるんだね♪
すべての銅原子を幸せにさせてあげよう!笑
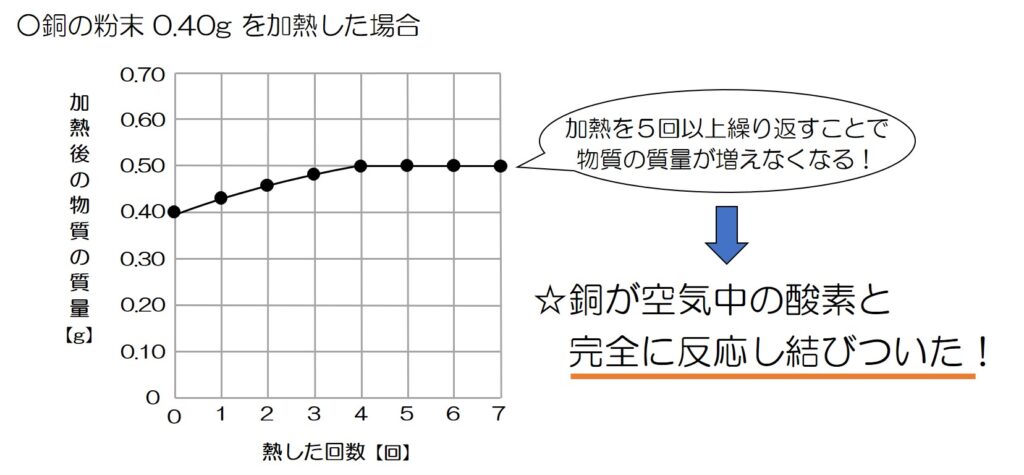
というわけで、このグラフの加熱4回目以降では、銅が酸素と完全に反応したことが分かる!
銅と酸素が結びつくときの割合
ラスト!(4)の問題!
それでは、あらためてグラフを見てみよう!
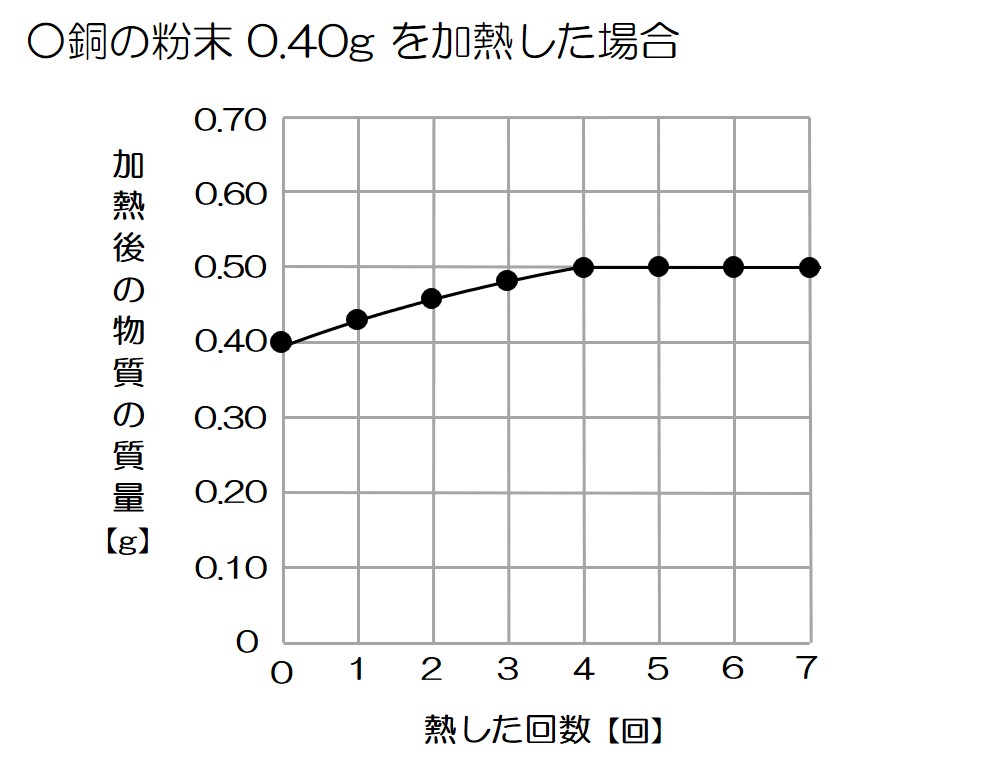
グラフより、0.4gの銅を加熱することで0.5gの酸化銅になって反応が終わったことが分かるね!
これはつまり、0.4gの銅を加熱することで0.1gの酸素が結びついたということ!
というわけで、その比は 0.4:0.1
これを簡単な整数比に直そう!
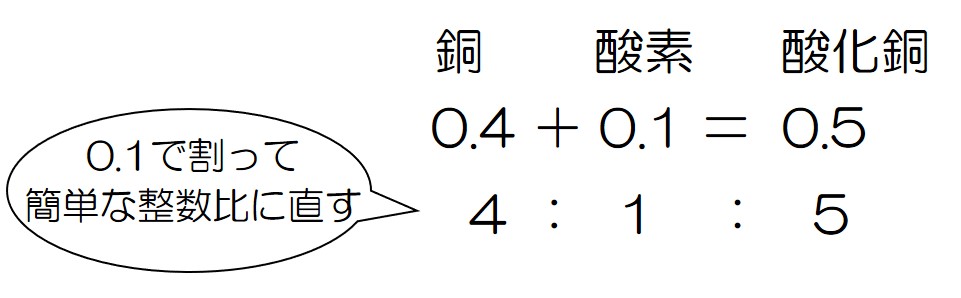
以上のことから、銅と酸素の結びつくときの割合は↓のようになる!


「銅と酸素は4:1」を覚えとくとめっちゃ楽やで♪




コメント